Jego ofiarami byli m.in. David Bowie i Romuald Lipko. A to zaledwie dwa z dziesiątek milionów nazwisk ofiar tej choroby. Szacuje się, że co roku diagnozę na raka wątroby słyszy około milion ludzi na całym świecie. Z tego 80 proc. umiera, bo zazwyczaj jest już za późno. Lek na raka wątroby testować ma polska firma Captor Therapeutics.

W 2022 r. zarejestrowano niemal 20 mln nowych zachorowań na raka. W przyszłości jedna na pięć osób – niezależnie od płci – może zmagać się z tą chorobą w trakcie swojego życia. Co bardziej niepokojące, około jeden na dziewięciu mężczyzn i jedna na dwanaście kobiet umiera na raka. To nie tylko miliony osobistych tragedii, ale także olbrzymie koszty ekonomiczne i społeczne dla krajów na przestrzeni najbliższych dziesięcioleci.
Jednym ze szczególnie śmiertelnych nowotworów jest rak wątroby, który kończy się śmiercią dla 8 proc. zdiagnozowanych. Walkę o ich życie toczy polska firma Captor Therapeutics, która zajmuje się rozwojem leków opartych o celowaną degradację białek (ang. targeted protein degradation, TPD). Jest to nowatorska technologia, która umożliwia eliminację niepożądanych białek z organizmu, takich jak te odpowiedzialne za rozwój chorób nowotworowych.
Polacy tworzą „snajpera” namierzającego patologiczne białka
Celowana degradacja białek to rewolucja w leczeniu chorób, które dotychczas – tak się wydawało – są nieuleczalne. W przeciwieństwie do większości istniejących leków (tzw. inhibitorów), leki oparte na TPD nie mają na celu spowalniania czy zatrzymania procesu zachodzącego wewnątrz komórek, lecz selektywne wyeliminowanie niepożądanych komórek. Innymi słowy, TPD ma działać jak snajper, który na zlecenie usuwa konkretne i szkodliwe dla organizmu białka.
Więcej o leku, badaniach i samej firmie dowiecie się z poniższego wywiadu z Michałem Walczakiem, dyrektorem naukowym Captor Therapeutics.
Karol Kopańko, Bizblog.pl: Zacznijmy od leków opartych o celowaną degradację białek. Jak działa ta technologia?
Michał Walczak, członek zarządu i dyrektor naukowy Captor Therapeutics: Większość obecnie stosowanych leków, zwanych inhibitorami, ma na celu opóźnienie lub zahamowanie procesów wewnątrzkomórkowych. Terapie oparte na TPD działają inaczej. Skupiają się na celowanym usuwaniu niechcianych białek. TPD w sposób precyzyjny eliminuje białka oraz wszystkie ich chorobotwórcze funkcje.
Tradycyjne leki nie są na tym polu skuteczne?
Blokują one aktywność białek, które są przyczyną choroby i zazwyczaj są obecne w organizmie przez ograniczony czas. Jest to istotne, aby uniknąć ich kumulacji w ciele pacjenta. Aby uzyskać pożądane efekty terapeutyczne, często konieczne jest stosowanie leku kilka razy dziennie (od jednego do trzech razy), aby ciągle hamować szkodliwą aktywność białek. Może to prowadzić do działań ubocznych oraz być niewygodne dla pacjentów. Co więcej, wiele z białek patologicznych prowadzi do rozwoju choroby wieloma szlakami, a inhibitory zazwyczaj blokują jeden z nich.
Wy usuwacie patologiczne białka, a standardowe podejście zakłada jedynie ich blokowanie. Rozumiem. Jak ta różnica przekłada się na komfort pacjenta?
Nasz lek może być podawany pacjentom rzadziej oraz w mniejszych dawkach. Dodatkowo nasze związki chemiczne działają nawet, jak lek zostanie usunięty z organizmu, ponieważ zanim chora komórka wyprodukuje nową pulę białka chorobotwórczego w odpowiednich ilościach, zazwyczaj mija sporo czasu. W środowisku TPD udało się też pokazać, że degradery mają zdolność pokonywania niektórych nabytych oporności nowotworów.
Sami opracowaliście tę technologię?
Pierwszy patent opisujący celowaną degradację białek pochodzi z roku 1999. Mimo że technologia ta jest znana od dawna, często uznaje się ją za nową, ponieważ do tej pory nie wprowadzono na rynek leków, które były zaprojektowane jako degradery białek. Istnieją na rynku leki działające na tej zasadzie, które jednak zostały opracowane bez wiedzy dotyczącej mechanizmu działania leków. Przykładem są Revlimid czy Pomalyst, których właściwości jako degraderów odkryto po latach ich stosowania.

Obecnie kończy się okres ochrony patentowej Revlimidu, stosowanego w terapii szpiczaka mnogiego i będącego jednym z najbardziej dochodowych leków w historii farmacji (roczne przychody dochodzą do 10 mld dol. - przyp. red.)
Dzięki temu technologia degradacji białek jest uznawana za w pełni sprawdzoną i o olbrzymim potencjale tak terapeutycznym, jak i komercyjnym. Na świecie działa obecnie około 60 firm o skali porównywalnej do naszej, które angażują się w rozwój tej technologii, nie wspominając o badaniach prowadzonych przez największe koncerny farmaceutyczne, czyli Big Pharma.
Jaka jest w takim razie wasza rola w procesie?
Rozwijamy i komercjalizujemy technologie celowanej degradacji białek. Firma może prowadzić własne badania i rozwój technologii, a także współpracować z innymi podmiotami naukowymi i komercyjnymi w celu dalszego rozwijania i wdrażania swoich rozwiązań.
Czytaj więcej o zdrowiu:
Na jakim stopniu zaawansowania są wasze projekty?
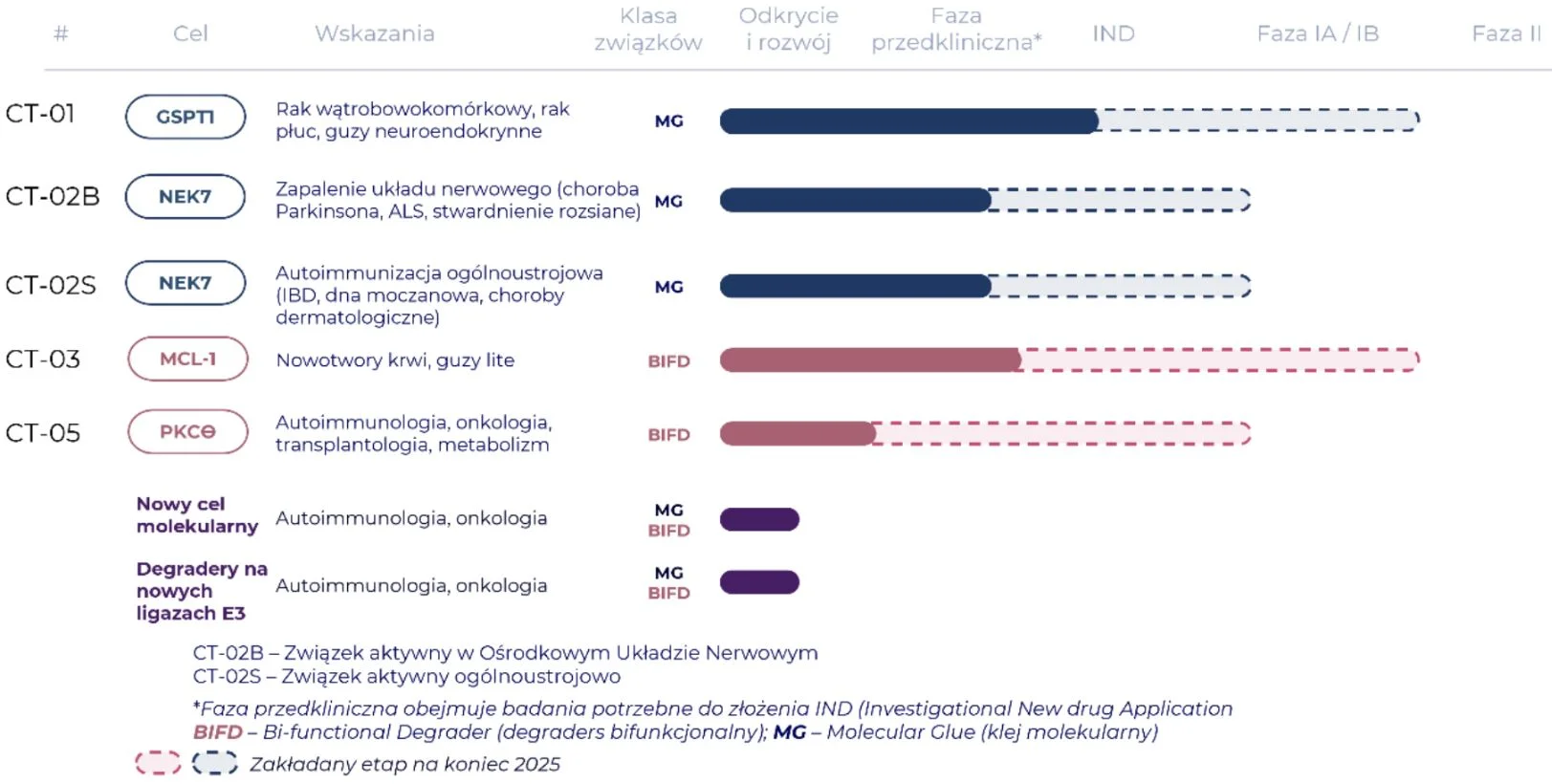
Nasz najbardziej zaawansowany projekt to CT-01, którego celem jest opracowanie kandydata na lek, który zatrzyma postęp raka wątrobowokomórkowego. Obecnie znajdujemy się na końcowym etapie przygotowania naszego leku w najmniejszej dostępnej dawce, czyli w formie kapsułek, które będą stosowane przez pacjentów. Po ich przygotowaniu będziemy mogli przedłożyć niezbędne dokumenty do organu regulacyjnego, aby uzyskać zezwolenie na przeprowadzenie badań klinicznych.
Pierwsza faza tych badań klinicznych zazwyczaj obejmuje stosunkowo ograniczoną liczbę uczestników i ma ona na celu ocenę potencjalnej toksyczności leku oraz jego dystrybucji w organizmie, co pozwala zweryfikować jego właściwości farmakokinetyczne. Kolejne fazy, druga i trzecia, przyciągają znacznie większe grupy pacjentów – od kilkuset do kilku tysięcy. Te etapy skupiają się na ocenie efektywności leku, w tym na analizie czasu przeżycia bez pogorszenia stanu zdrowia.
Ile czasu może to zająć?
Oś czasu dla komercjalizacji takiej technologii obejmuje fazy badań i rozwoju, testy przedkliniczne, różne fazy badań klinicznych, aż do uzyskania zezwolenia na dopuszczenie do obrotu od regulatorów. Cały proces może trwać od kilku do nawet kilkunastu lat, w zależności od wyników badań, regulacji i finansowania.
W przypadku Captor Therapeutics wygląda to następująco:
Widzę, że projekt CT-01 jest najbardziej zaawansowany.
W jego ramach zakończyliśmy wszystkie niezbędne badania farmakologii bezpieczeństwa i skuteczności oraz produkcję substancji aktywnej przeznaczonej do leczenia raka wątrobowokomórkowego. Dzięki wsparciu ICON, światowego lidera w prowadzeniu badań klinicznych dla podmiotów zewnętrznych, spółka pozyskuje ośrodki kliniczne w Europie.
Z jakim spotykacie się zainteresowaniem?
Zainteresowanie było tak znaczące, że nie byliśmy w stanie przyjąć wszystkich we wstępnych badaniach, a jest to zjawisko bardzo rzadkie. Świadczy o dużej potrzebie nowych metod leczenia tej choroby oraz o znakomitych wynikach naszych badań przedklinicznych.
Aktualnie kończymy przygotowania kapsułek z lekiem, co pozwoli nam na złożenie wniosku o rozpoczęcie badań klinicznych jeszcze w tym roku. Ta chwila otworzy przed nami nowe szanse rozwojowe, nie tylko w obszarze biotechnologii, ale także na rynku kapitałowym. Postępy w rozwoju naszych kluczowych projektów skłaniają nas do optymistycznego spojrzenia na najbliższe miesiące, również w kwestii możliwości nawiązania partnerstw z podmiotami zagranicznymi.
A pozostale projekty?
W ramach projektu CT-03, ukierunkowanego na degradację białka MCL-1 w terapii nowotworów układu krwionośnego, limfatycznego oraz guzów litych, firma zbliża się do momentu uruchomienia pakietu IND, który następnie umożliwi rozpoczęcie badań klinicznych. Rozwijany w ramach projektu kandydat na lek jest obecnie jedynym degraderem białka MCL-1 rozwijanym przez przemysł farmaceutyczny. Dzięki temu widzimy olbrzymią szansę na rozwój cząsteczki typu „first-in-class” dla tego niezwykle ważnego celu molekularnego w leczeniu nowotworów.
W 2023 r. firma uzyskała dane in vitro, jak i wstępne dane in vivo dotyczące CT-02 i CT-05, które potwierdziły wysoką efektywność i selektywność tych związków w degradacji określonych celów molekularnych. Te odkrycia przyciągnęły uwagę dużych firm farmaceutycznych. Ze względu na odmienne profile farmakologiczne dwóch serii wiodących w projekcie CT-02, firma postanowiła wyodrębnić dwa projekty. Jeden z nich jest skierowany na leczenie chorób zapalnych Ośrodkowego Układu Nerwowego, druga zaś skupia się na leczeniu ogólnoustrojowych chorób autoimmunologicznych. To z kolei zapoczątkowało rozmowy o współpracy z potencjalnymi partnerami zainteresowanymi zarówno terapią systemową, jak i terapią skierowaną do ośrodkowego układu nerwowego.

Obecnie Captor Therapeutics aktywnie poszukuje partnerów do współpracy nad projektem CT-05 oraz oboma inicjatywami w ramach CT-02, aby skoncentrować swoje zasoby badawcze przede wszystkim na projektach CT-01 i CT-03
Wiem, że macie dwie siedziby. Jak firma dzieli swoją obecność między Polskę a Bazyleę?
Polska jest kluczowym miejscem dla działalności badawczo-rozwojowej Captor Therapeutics. Tutaj znajduje się główna baza naukowa firmy, która skupia się na badaniach nad nowymi terapiami oraz ich rozwojem. W Polsce firma może korzystać z wykwalifikowanej kadry naukowej oraz współpracować z polskimi uczelniami i instytutami badawczymi.
Bazylea w Szwajcarii jest znana jako jedno z najważniejszych centrów farmaceutycznych na świecie. Lokalizacja w Bazylei umożliwia Captor Therapeutics dostęp do konsultantów o bardzo niszowych specjalizacjach w rozwoju leków, sieci biznesowych oraz możliwości nawiązania współpracy z globalnymi graczami w branży farmaceutycznej. Ponadto Bazylea może służyć jako strategiczne miejsce do rozwijania komercyjnych aspektów technologii, w tym marketingu i sprzedaży na rynkach europejskich i międzynarodowych.
Dzięki podziałowi operacji między Polską a Bazyleą, Captor Therapeutics łączy lokalne kompetencje badawcze i rozwojowe z globalnym zasięgiem i dostępem do światowej klasy ekosystemu biotechnologicznego. Obecność w obu lokalizacjach umożliwia firmie efektywnie prowadzić działalność naukową i komercyjną, co przyczynia się do przyspieszenia procesów badawczych i wprowadzania innowacyjnych terapii na rynek.